NOTICIAS - EMAIL - CORREO RECIBIDO - EL LIBRO - ARTíCULOS - AMAZONAS - ENGLISH VERSION - PILOT NOTES - LINKS
Preocupación Sobre la Salud Pública Acerca de
los Bifeniles Policlorados (PCB) en el Ambiente
Toma de Posición del American Council on Science and Health (ACSH)
y la Fundación Argentina de Ecología Científica (FAEC)
Esta es una actualización a 1997 del informe de 1991 de Leonard T. Flynn, Ph.D., M.B.A.
Traducción del inglés de Eduardo Ferreyra (Julio 2003)
Cindy F. Kleiman, M.P.H., Coordinadora del Proyecto
Abstracto
Los Bifeniles Policlorados, o PCB, fueron usados extensamente en varias aplicaciones industriales por su propiedades aislantes y retardante del fuego. En los años 60, se encontraban PCB en suelos y aguas, y la investigación confirmó que algunos congéneres de PCB se degrada muy lentamente en el ambiente, y se pueden acumular en la cadena alimenticia. Dos extendidos episodios ocurridos en Japón y Taiwán fueron inicialmente atribuidos al consumo de aceite de arroz contaminado con PCB. Aunque los análisis subsecuentes sugerían que la degradación térmica tóxica de productos del PCB en el aceite, más que los PCB en sí, eran los responsables de los efectos observados sobre la salud, la producción comercial de PCB se discontinuó en los Estados Unidos en 1979.
Varias agencias reguladoras y asesoras han categorizado a los PCB como cancerígenos en los animales; sin embargo, los estudios de obreros expuestos a elevadas dosis de PCB durante largos períodos de tiempo no han mostrado un aumento en el riesgo de cáncer. De hecho, el único efecto sobre la salud que pudo ser atribuido a los PCB fueron la irritación de ojos y de piel. Recientes estudios sobre los posibles efectos de la exposición prenatal a los PCB sobre el desarrollo neuronal de los bebés y niños han sido criticados por sus deficiencias metodológicas.
No existen evidencias concluyentes de que los niveles de PCB en la población estén causando deterioro intelectual entre los niños expuestos in útero. Algunos investigadores han sugerido también que los PCB y otras sustancias químicas en el ambiente pueden interferir con el sistema endocrino del organismo, conduciendo a la infertilidad, ciertos tipos de cáncer, y otros desórdenes relacionados con las hormonas. La evidencia de efectos estrogénicos de los PCB en al ambiente permanece siendo débil y circunstancial.
Se recomiendan las siguientes acciones: desarrollo de innovadoras y costo-efectivas técnicas de remediación, particularmente para sitios difíciles de remediar (por ej.; los sedimentos de ríos); y mejoras con base científicas de las evaluaciones de riesgo, para reducir la considerable incertidumbre que existe en la exposición a los PCB y la salud humana.
Resumen Ejecutivo
Los Bifeniles Policlorados (PCB), son una familia de más de 200 compuestos químicos (congéneres). Cada uno de los cuales consta de dos anillos bencénicos y de uno a diez átomos de cloro. Se usaron en una gran variedad de aplicaciones industriales debido a sus propiedades aislantes y retardantes del fuego. La preocupación sobre la presencia de los PCB en el ambiente comenzó hacia los años 60, cuando se encontraron PCB en el suelo y en el agua, y la investigación confirmó que algunos congéneres de PCB se degrada muy lentamente en el ambiente, y se pueden acumular en la cadena alimenticia. En 1968, un extendido episodio de intoxicación en el oeste del Japón (llamado Yuso), o enfermedad del aceite), fue atribuido al principio al consumo de aceite de arroz contaminado con PCB.
Aunque los análisis subsecuentes mostraron la presencia de productos tóxicos por la degradación térmica en el aceite, que ahora se cree que fueron los responsables de los efectos observados sobre la salud, el incidente de Yuso y otro similar en Taiwán (Yu-Cheng) aumentaron la preocupación sobre la seguridad de los PCB. En los años 70s, se restringió la producción comercial de PCB, y finalmente terminó en 1979.
Los PCB no provocan efectos agudos sobre la salud de los animales, excepto a dosis extremadamente altas. Sin embargo, se ha probado que causan tumores en animales. Varias agencias reguladoras y asesoras, incluyendo a la Agencia de Protección del Ambiente (EPA) han determinado que existe suficiente evidencia para considerar a los PCB como cancerígenos animales. No obstante, estudios realizados sobre obreros expuestos a la inhalación y contacto de la piel de altas dosis de PCB durante extensos períodos de tiempo, no han demostrado que un aumento del riesgo de cáncer. De hecho, la irritación de ojos y piel fueron los únicos efectos observados en los obreros y que podían ser atribuidos al PCB.
En los episodios de Japón y Taiwán mencionados más arriba, el consumo del aceite de arroz contaminado con PCB dio por resultado una severa forma de acné llamada cloroacné, fatiga, náusea, y desórdenes del hígado. Hubo también un aumento de la mortalidad por cáncer en el incidente Yuso, y un aumento de la mortalidad por otras enfermedades del hígado en el incidente Yu-Cheng. Los niveles de PCB en la sangre de los obreros expuestos al PCB excedían a los las víctimas de los incidentes Yuso y Yu-Cheng. Se cree que esto se debe a la presencia de sustancias generadas por la degradación térmica de los PCB en el aceite de arroz. Estas sustancias, los furanos (similares a las dioxinas) y los cuarterfeniles, son mucho más tóxicas que los PCB.
Los estudios de personas que comieron pescado contaminado con PCB mostraron que, mientras la cantidad de pescado consumida se correlacionaba con el nivel de PCB en sangre, no existían significativas diferencias de salud entre los que consumieron una gran cantidad de pescado y aquellos con exposiciones más bajas. Un estudio de 1996 sugería que la exposición prenatal a los PCB por la ingesta materna de pescado contaminado estaba asociada con efectos en el desarrollo neuronal de bebés y niños. Sin embargo, esto es inconsistente con estudios que no han hallado relación entre la exposición materna a los PCB y el peso de los recién nacidos o la circunferencia del cráneo. Los problemas con la metodología del estudio, específicamente, evaluación de la exposición y selección del grupo de control (comparación), limitan más todavía la interpretación de los resultados del estudio de 1996.
Además, ya que las concentraciones de PCB en la sangre materna eran apenas ligeramente mayores que las existentes en la sangre de sujetos que informaron no haber comido pescado (y estaban dentro del rango de concentración de PCB en sangre existente en los EEUU), deberíamos estar presenciando un extendido fenómeno a lo largo y ancho de los EEUU si los PCB realmente pudiesen ser la causa de deterioro mental en los niños. No existe ninguna evidencia de un extendido deterioro intelectual entre los niños, por lo tanto, advertir a los padres no está recomendado en estos momentos.
Se ha sugerido que las sustancias químicas como los PCB en el ambiente pueden imitar a las hormonas naturales del organismo (p. Ej.: estrógenos), y que esta disrupción endocrina (hormonal) puede conducir a la infertilidad, ciertos tipos de cáncer y a otros desórdenes relacionados con las hormonas. Sin embargo, la evidencia de efectos estrogénicos de los PCB ambientales ya sea en humanos o animales sigue siendo débil y circunstancial, y se han sacado conclusiones prematuras basadas en evidencia incompleta e inadecuada. Numerosos investigadores han caracterizado como no plausible y no probada a la hipótesis de que los estrógenos ambientales causan un aumento del cáncer de mama, o problemas reproductivos en los hombres.
En resumen, no existe ninguna evidencia concluyente de que los niveles de fondo de PCB en la población en general, o aún los muy altos niveles a que fueron expuestos ciertos grupos ocupacionales, no dieron por resultado efectos agudos, aumento del riesgo de cáncer, disrupción endocrina, o extendido deterioro intelectual en los niños expuestos in útero a los PCB. En realidad, aún aquellos efectos notados en las poblaciones expuestas a los PCB, p. ej.: cloroacné, no pueden ser definitivamente ligadas a los PCB a causa de la exposición simultánea a otros conocidos agentes tóxicos, tales como los furanos y los cuarterfeniles.
Es importante reconocer que los PCB comerciales y ambiental consisten en una mezcla de congéneres individuales de PCB. Estos congéneres varían en su grado de toxicidad y la toxicidad de cualquier mezcla depende de la toxicidad de los congéneres individuales. Los estudios de laboratorio de los PCB son, en su mayoría, realizados sobre el producto comercial. Sin embargo, los PCB degradados en el ambiente, a los cuales están expuestos las personas, pueden diferir en su composición y toxicidad de la mezcla comercial de PCB original. Las agencias reguladoras están comenzando a reconocer que esto es un factor muy importante para la evaluación del riesgo a la exposición a los PCB en el ambiente.
A causa de la prohibición de la producción de PCB, disminución de su uso, y esfuerzos para remediar sitios contaminados, se ha reducido de manera significativa la exposición de la población a los PCB en pescados y otras comidas, y los niveles de PCB en la sangre humana también están disminuyendo. La industria y el gobierno deberían concentrarse en el desarrollo de novedosas y efectivas técnicas de remediación y disposición final, como también en mejorado análisis de riesgo de salud para reducir la incerteza asociada con la exposición a los PCB y los efectos sobre la salud humana.
1. INTRODUCCIÓN
Los Bifeniles Policlorados (PCB), son una familia de más de 200 compuestos químicos estructuralmente relacionados (congéneres), cada uno de los cuales consta de dos anillos bencénicos y de uno a diez átomos de cloro. (Fig. 1). Varían en un rango desde livianos y aceitosos fluidos, a pesados, grasosos o cerosas sustancias. Se usaron en una gran variedad de aplicaciones industriales hasta que la preocupación por posibles consecuencias adversas para la salud y el ambiente dieron por resultado la prohibición de su fabricación. Este informe está redactado para explicar la historia y toxicidad de los PCB, y las acciones reguladoras que se han tomado, con el objeto de proveer una perspectiva científica y equilibrada del tema.
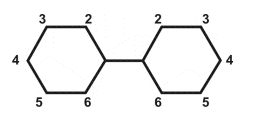
Figura 1: Estructura Química Básica de los PCB
Los números 2-6 y 2'-6' representan posibles posiciones del átomo de cloro dentro de cada anillo bencénico. Existen 209 miembros específicos de la familia de PCB (o congéneres). Cada congénere PCB es único con respecto a la posición del cloro. Por ejemplo, un PCB con 4 átomos de cloro es un tetraclorobifenil (bifernil se refiere a los dos anillos bencénicos, o anillos fenil); un nombre más específico, p.ej.: 3,3',4,4'-tetraclorobifenil, indicaría la posición exacta de los cuatro cloros dentro del anillo bencénico.
Los PCB fueron descubiertos hace más de 100 años; su producción comercial y uso comenzó en 1929. A causa de su notable capacidad aislante y su naturaleza retardante de la llama, muy pronto ganaron un uso extendido como enfriadores y lubricantes en transformadores y otros equipos eléctricos, donde estas propiedades son esenciales. Los PCB reemplazaron a los aislantes fluidos inflamables y en consecuencia se redujo el peligro de incendios en edificios de oficinas, hospitales, fábricas, y escuelas. De hecho, algunos códigos de edificación de muchas ciudades prohibieron el uso del aceite mineral para aislamiento y exigieron que los condensadores y transformadores fueran del tipo PCB. No sólo hizo el PCB resistente al fuego a los transformadores y condensadores, sino que también permitió hacerlos más pequeños, reduciendo así el costo de los equipos. En muchas localidades las compañías de seguro exigían equipos con PCB.
Durante varias décadas, los PCB fueron usados de manera rutinaria en la fabricación de una amplia variedad de productos comunes como plásticos, adhesivos, pinturas y barnices, pesticidas, papel carbónico sin carbón, tintas de imprenta, balastos de luces fluorescentes, y compuestos para enduídos. Se estima que entre 1929 y 1977 se produjeron 1.100 millones de libras de PCB en los EEUU. Monsanto era el único productor en los EEUU.
Aunque la producción de estos compuestos ha cesado en los Estados Unidos, los PCB han sido identificados en 387 de los 1416 basureros riesgosos identificados en el programa Superfund (ATSDR 1996). Los PCB persisten en el ambiente, y por ello continúan siendo detectados mucho tiempo después de que su fabricación cesó. Además, potenciales fuentes de PCB existen aún debido a las viejas prácticas de disposición final.
2. ¿Cómo entraron los PCB al ambiente?
En el pasado, las descargas de desperdicios cargados de PCB en los ríos, arroyos, y basureros a cielo abierto eran consideradas aceptables, legales, y una práctica libre de riesgos. Algunas veces los PCB eran lanzados intencionalmente al ambiente , por ejemplo, para reducir la emisión de polvo en los caminos de tierra, o como extensores en algunas fórmulas de pesticidas agrícolas. En visión retrospectiva, estas prácticas eran inapropiadas y potencialmente dañinas.
También hubo liberaciones accidentales al ambiente de PCB y contaminantes asociados a través de fugas y goteo de los compartimentos de PCB sellados, durante el uso comercial de transformadores y condensadores, y como resultado de una inadecuada disposición final de equipos conteniendo PCB. También ocurrió contaminación de alimento para consumo animal y humano como consecuencia de fugas de PCB de alambiques y espirales de calentamiento durante la manufactura de alimentos. Los PCB también pueden ingresar a la cadena alimenticia a través de la ingestión de pescado contaminado por PCB en las aguas.
Finalmente, los fuegos e incendios eléctricos de transformadores y condensadores llevaron a la liberación accidental de PCB y productos de degradación térmica como las dibenzo-dioxinas policloradas (PCDD), los dibenzofuranos policlorados (PCDF), y cuaterfeniles policlorados (PCQ). Estos productos de combustión incompleta son considerados más tóxicos que los PCB, como se discute más abajo.
3. Preocupación Histórica Acerca de los PCB
La preocupación acerca de la presencia de PCB en el ambiente comenzó alrededor de 1966 cuando investigaciones en Suecia revelaron la presencia de PCB en muestras del ambiente (suelos y agua) que eran analizadas buscando DDT (Jensen, 1966). Estudios posteriores confirmaron las sospechas de que la tasa de biodegradación (o descomposición natural) era muy lenta para algunos de los congéneres de PCB (Jensen, 1972).
En 1968, un extenso episodio de intoxicación en el oeste del Japón fue atribuido al consumo de aceite de arroz que se había contaminado con PCB durante el procesado. Creció la preocupación mundial acerca de los efectos potenciales del PCB sobre la salud. Esta preocupación fue espoleada por otro episodio de intoxicación humana en 1978, involucrando aceite de arroz contaminado con PCB en Taiwán.
En 1971, la compañía Monsanto limitó voluntariamente los tipos de mezclas de PCB producidas (cada una con la marca registrada Aroclor) a aquella conteniendo menos de 60% de sustitución de cloro (por peso), y reformuló uno de los Aroclor para reducir el porcentaje de los PCB más altamente clorados. Una serie de decisiones del gobierno de EEUU llevaron a regular a los PCB bajo el Acta de Control de Sustancias Tóxicas (TSCA) en 11976. En 1974 se emitió una regulación para restringir el uso de PCB a las aplicaciones de sistemas cerrados (principalmente transformadores y condensadores). La decisión de prohibir definitivamente la producción comercial de PCB se alcanzó en 1976, aunque la producción en los EEUU no finalizó sino recién en 1979. No existe producción comercial de PCB en Europa, mientras que las cifras mundiales de producción no se conocen.
Los PCB son considerados ahora como contaminantes ambientales ubicuos (Atlas y Giam, 1981; Bacon et al., 1992, Ballschmitter, 1991, Wasserman et al., 1979, Wolf et al., 1982). Estas sustancias químicas se bioacumulan en la cadena alimenticia, a causa de su relativa insolubilidad en agua y alta solubilidad en grasas, los PCB se almacenan en la grasa del cuerpo). Sin embargo, la persistencia en el ambiente no significa necesariamente que amenacen a la salud pública.
4. ¿Causan los PCB Cáncer y Otros Serios Problemas en Animales?
El peso de la evidencia experimental apoya la conclusión de que los PCB pueden causar cáncer en los animales. Extensas revisiones hechas por la Agencia Internacional para la Investigación sobre el Cáncer (IARC, 1987), el Programa Nacional de Toxicología (NTP, 1989), la Conferencia Americana de Higienistas Industriales Gubernamentales (ACGIH, 1996), y la Agencia de Protección del Ambiente de los EEUU (EPA, 1996a,b).han determinado que existe suficiente evidencia para considerar que los PCB son cancerígenos en los animales. El contenido de cloro era previamente considerado como un factor importante en el grado de carcinogenicidad de particulares mezclas de PCB. Sin embargo, estudios recientes (Brunner et al., 1996) sugieren que la posición de los cloros en la molécula de PCB es también un determinante clave del potencial cancerígeno. Este tema será importante para las futuras evaluaciones de la EPA sobre respuesta a las dosis. (EPA, 1996b).
En varios estudios sobre animales se han observado efectos (fuera de cáncer) sobre el hígado, los sistemas inmunológico, nervioso, y reproductivo, y otros sistemas orgánicos (ATSDR, 1996, WHO, 1993). La toxicidad sistémica ocurre más frecuentemente a partir de la ingestión, más que por la absorción a través de la piel.
Ha surgido una reciente preocupación sobre la degradación de PCB a PCDF y PCDD durante la combustión de los fluidos en los incendios de equipos eléctricos, o en condiciones de incineración inadecuadas (Hutzinger et al., 1985). El estudio de estos compuestos degradados en animales ha demostrado efectos tóxicos a niveles de dosis mucho menores de PCDD o PCDF (Bandiera et al., 1984). Esto es significativo, ya que el análisis del aceite de arroz contaminado en Japón y Taiwán revela que el fluido de PCB fue parcialmente degradado por el calor y contenía elevados niveles de PCDF y PCDD.
La actual política de la EPA es considerar a las sustancias químicas que producen cáncer en animales como potenciales cancerígenos humanos. Sin embargo, cuando se interpretan los resultados de los estudios de toxicidad animal, se debe de tener en cuenta lo siguiente:
- Las diferencias Inter-especies entre los animales de laboratorio usados en los ensayos y los seres humanos
- Variaciones dentro de la población humana, dependiendo de la edad, sexo, y susceptibilidad individual, y
- Las muy grandes dosis del agente administradas a los animales en los experimentos. Los efectos observados a estas muy elevadas dosis pueden resultar irrelevantes para los seres humanos expuestos a dosis mucho menores.
En resumen, la actual evidencia científica indica que los PCB son cancerígenos y tóxicos para los animales bajo condiciones de elevada exposición crónica. El conocimiento del posible rol de los cuarterfeniles y furanos en el incidente de Yuso vino después de que el público ya estaba alarmado por la exposición a los PCB. El asunto de la contaminación química de PCB en Japón y Taiwán sigue complicando la interpretación de datos de seres humanos y animales sobre los efectos agudos y cancerígenos de los PCB.
5. ¿Causan los PCB Efectos sobre la Salud Humana?
Los efectos sobre la salud están tradicionalmente clasificados en crónicos o agudos. Con respecto a la exposición al PCB, los efectos agudos son respuestas fisiológicas que ocurren poco después de la exposición. Cloroacné y, posiblemente, neuropatía periférica (efectos adversos en los nervios periféricos asociados con los músculos, la piel, y las articulaciones) han sido asociadas con exposiciones de corta duración a los PCB, aunque, como se mencionó más arriba, los productos de la degradación de los PCB, más que los PCB en sí mismos, han sido los verdaderos culpables. Se ha informado de dermatitis por contacto en operarios expuestos a los PCB que fueron, sin embargo, también expuestos a compuestos epóxicos, conocidos sensibilizadores de la piel.
Los efectos crónicos se refieren principalmente a respuestas ocurridas después de exposiciones prolongadas, incluyendo el desarrollo de cáncer. No obstante, recientemente se han investigado también otros efectos tales como los relacionados con la reproducción y la disrupción endocrina en relación a la exposición a los PCB (Falck et al., 1992; Krishnan y Safe, 1993). De manera general, la mayor parte de los efectos (fuera del cáncer) asociados con la exposición a químicos, tienen un umbral específico de exposición (es decir, una dosis por debajo de la cual no ocurren efectos adversos). La EPA se basa en este concepto para establecer dosis de referencia (RfDs), dosis a las que hasta los miembros más sensiubles de la población pueden ser expuestos durante un período de vida completo (72 años) sin observarse efectos adversos sobre su salud. La EPA ha establecido RfDs para dos mezclas específicas de PCB: Aroclor 1254 (0,02 microgramos/kg peso corporal por día) y Aroclor 1016 (0,07 microgramos/kg/día) (EPA, 1996a).
Los epidemiólogos han intentado identificar aumentos de la incidencia de efectos crónicos y agudos entre los grupos expuestos a los PCB (Brown y Jones, 1981; Vertáis et al., 1987, Gustavsson et al., 1986; Salta et al., 1989, NIOSH, 1977, Davidorf y Krupp, 10979; Yassi et al., 1994). En este tipo de estudios, los efectos sobre la salud de grupos fuertemente expuestos a los PCB son comparados con los efectos observados en grupos de control, individuos que no han tenido contacto con PCB más allá de los niveles de fondo. Estos tipos de estudios pueden examinar exposiciones rutinarias y accidentales en condiciones ocupacionales o de otro tipo.
5. Estudios Ocupacionales
Han pasado más de 60 años desde que los operarios fueron expuestos fuertemente a los PCB. Un período que debería de ser suficiente para detectar enfermedades como el cáncer, que tienen períodos de latencia de 10 a 30 años (el tiempo que media entre la exposición inicial y el desarrollo de la enfermedad).
Los estudios ocupacionales más extensos de exposición a largo plazo de PCB se han enfocado sobre trabajadores empleados en la construcción de equipamientos eléctricos. Estos individuos tuvieron una exposición cutánea diaria con los PCB durante muchos años, inhalaron niveles de PCB relativamente altos, y probablemente ingirieron algo del producto al comer cerca de sus lugares de trabajo. Fuera de irritación de la piel y los ojos, y quizás una inducción de enzimas del hígado (un signo de actividad metabólica aumentada del hígado), no se pudieron detectar ni atribuir efectos agudos o crónicos a los PCB. A pesar de altas concentraciones de PCB en suero y en grasas de estos trabajadores, no se detectó la severa forma de cloroacné y otros efectos observados en los incidentes de Yuso y Taiwán (Rosenman, 1992).
Cuatro estudios ocupacionales son particularmente importantes:
- El NIOSH (Instituto Nacional para la Seguridad Ocupacional y Salud) estudió trabajadores de mantenimiento expuestos a los PCB en dos compañías eléctricas (Smith et al., 19881a). Las concentraciones de PCB en sangre eran mucho más elevadas en esos trabajadores que en el nivel nacional de fondo (12 a 298 partes por mil millones [ppmm] versus 10 a 20 ppmm. Los trabajadores no demostraron tener ningún efecto sobre su salud, ni siquiera cloroacné.
- El NIOSH estudió 224 trabajadores expuestos al PCB en una planta de manufactura de equipos eléctricos y encontró concentraciones de PCB en sangre variando de 15 a 3.580 ppmm. A pesar de tales elevadísimos niveles, no se observaron efectos adversos ) Smith et al., 1981b)
- Lawton et al. (1985) estudiaron la salud de 194 trabajadores fuertemente expuestos al PCB durante un promedio de 15 años, con algunos casos hasta 35 años. El primer informe de trabajadpres seguidos hasta 1976 no mostraron efectos adversos. Una reevaluación en 1979 tampoco produjo evidencias de afectos adversos sobre la salud de estos trabajadores.
- El más completo estudio sobre los efectos a largo plazo de la exposición a los PCB involucró a más de 2.500 trabajadores empleados en dos distintas plantas manufactureras de condensadores eléctricos (Brown y Jones, 1981). Los investigadores del NIOSH no identificaron ningún exceso significativo de cánceres individuales entre los trabajadores, la mayoría de ellos con 20 años en el trabajo. El NIOSH informó que la mortalidad total por cáncer para esta población ocupacionalmente expuesta era ligeramente menor que la de la población de los Estados Unidos en general. Se observaron 39 casos de cáncer, aunque se hubiese debido esperar 43 en una población con un perfil demográfico similar (es decir: distribución similar de edad/raza/sexo) a los de los 2.500 trabajadores estudiados. Además, no había una clara y estrecha respuesta de correlación ente la duración del empleo en los trabajos con PCB y el riesgo de mortalidad debido al cáncer.
Estos estudios no encontraron correlación ente el nivel de exposición y el efecto, y por consiguiente no proveyeron evidencia de que la exposición a los PCB incrementa el riesgo de cáncer en los humanos (ATSDR, 1996). Dado el pequeño número de casos en estos estudios, se mantiene la posibilidad de que los trabajadores altamente expuestos podrían eventualmente desarrollar enfermedades relacionadas con los PCB y aumentar su mortalidad. Está claro, sin embargo, que los serios problemas de salud (agudos y crónicos), que se observaron en los incidentes de Japón y Taiwán, no se han observado como resultado de la exposición ocupacional a los PCB (Rosenman, 1992).
5.2 Los Incidentes de Yuso y Yu-Cheng
En 1968, unas 1300 personas en Fukuoka, Nagasaki y otras áreas del oeste de Japón, se enfermaron por ingerir aceite de arroz contaminado con 2.00 a 3.000 partes por millón (ppm) de una marca japonesa de un agente de transferencia de calor (Kunita et al., 1984; Kuratsune, 1989). Las víctimas desarrollaron una muy severa y persistente forma de acné, llamada cloroacné, Los síntomas de la enfermedad progresaron hasta convertirse en náuseas, e hinchazón de brazos y piernas; algunas personas desarrollaron desórdenes en el hígado. También se informaron de manifestaciones neurológicas (primariamente subjetivas en su naturaleza). Algunos recién nacido de madres expuestas exhibieron pequeño tamaño, decoloración de la piel y uñas, y erupción prematura de los dientes (Kuratsune et al.,2972).
Durante los cinco años posteriores a la intoxicación de Japón, unos 1200 casos de "enfermedad del aceite" se habían reportado y, para 1977, se habían reconocido ya 1665 casos. Durante los 11 años siguientes a la exposición, 51 pacientes Yuso habían muerto. La causa de la muerte se determinó en 31 casos, y 11 de estos (o 35%) se debieron a cáncer. En una población similar no expuesta, sólo el 21% se habría esperado que muriesen de cáncer. Ikeda et al., (1985) examinaron las muertes de 1761 paciente Yuso hasta 1983. Se observó un exceso de la mortalidad por cáncer de hígado, tanto en hombres como en mujeres, pero era estadísticamente significativo sólo para los hombres. Sin embargo, la distribución geográfica de las muertes por cáncer de hígado era marcadamente despareja, ocurriendo casi todas en Fukuoka, mientras que no se había observado tal exceso en Nagasaki.
Un episodio de intoxicación similar ocurrió en Taiwán en 1978 y fue reportado como la enfermedad "Yu-Cheng". Otra vez, el aceite de arroz contaminado por compuestos degradados de PCB y subsecuentemente ingerido por más de 2000 personas. Entre las víctimas de Yu-Cheng se observaron efectos similares a los de Yusho. Los recién nacidos de las madres Yu-Cheng también exhibían síntomas de toxicidad aguda (Rogan, 1989, Rogan et al., 1988). Se observó una elevada mortalidad por enfermedades del hígado fuera del cáncer - en los tres años posteriores a la ocurrencia de la intoxicación (Hsu et al., 1865; Hsieh et al., 1996).
En los años que siguieron a los incidentes de intoxicación de Japón y Taiwán, evidencia adicional indicó que los PCB podrían no ser la única causa de los síntomas asociados con enfermedades. Los análisis revelaron que el fluido de transferencia de calor que contaminó al aceite de arroz contenía significativos niveles de PCDF y PCDD (Buser et al., 1978, Chen et al., 1981; Miyata et al., 1985, 1977).
Los niveles de PCB en la sangre de los trabajadores en condensadores de Japón y Taiwán eran mayores que en los pacientes Yusho y Yu-Cheng. Estos descubrimientos, y aquellos de experimentos de alimentación con monos, donde sólo experimentaban efectos cutáneos cuando se le añadía PCDF a las dosis de PCB o PCCQ, sugieren que los efectos observados en las victimas Yusho y Yu-Chrng no fueron el resultado de exposición a PCB puros, o mezclas comercialmente producidas, sino que fueron la consecuencia de otros contaminantes presentes junto a los PCB, por ej.; PCQ, PCDD y, más importante, PCDF (Kurita et al., 1984, Kashimoto et al., 1981, Kashimoto y Miyatu, 1986).
Los niños y las víctimas de los incidentes Yusho y Yu-Cheng fueron seguidos en varios estudios. Se observaron defectos del desarrollo (anormalidades en uñas, cambios músculo esqueléticos, problemas de conducta, y déficit de la cognición), y se piensa que fueron el resultado de altas exposiciones a una muezcla que contenía CDF, PCQ y PCDD, involucrando niveles maternales de hasta 200 veces los vistos en las exposiciones ambientales al fondo natural (Rogan, 1989; Rogan et al., 1988; Feeley, 1996; Chen et al., 1992; Yu et al., 1991).
5.3 Estudios Recientes de los Efectos de
Exposición a Bajos Niveles de PCB
Los investigadores han continuado investigando los efectos reproductivos y de desarrollo de las exposición a bajos niveles de PCB y otros contaminantes relacionados. Se condujeron estudios epidemiológicos en Michigan, Holanda, y Carolina del Norte.
Algunos de estos estudios examinaron a niños nacidos de madres que consumieron pescado con altos niveles de PCB antes y durante el embarazo. Otros estudios examinaron a los niños nacidos de mujeres sin exposición conocida a los PCB, otra que a los niveles de fondo. Estos son estudios extensos y continuados que han seguido a los niños a través de la infancia. En todos los estudios, las madres no mostraron señales de toxicidad por PCB. Para poder correlacionar posibles efectos reproductivos con los niveles de la exposición materna, se recolectaron muestras de suero de los cordones umbilicales, leche materna, y de sangre de la madre.
Se informó de menor peso en recién nacidos de madres que consumieron pescado contaminado, pero no fue correlacionado por los niveles de exposición materna (Fein et al., 1864). Hubo reportes de exposición prenatal a los PCB relacionados con déficit de desarrollo neurológico entre el subgrupo más expuesto de una cohorte de niños de Carolina del Norte. Entre estos se observó déficit motriz al nacimiento (Fein et al., 2984, Rogan et al., 1996; Gladen y Rogan, 1991), déficit en habilidad motora al final del primer año (Gladen et al., 1988), deterioro de la memoria de reconocimiento visual a los siete meses de edad (Jacobson et al., 1985), y calificaciones psicomotoras sustancialmente menores (en la Escala Bayley de Desarrollo Infantil) a los 18 y 24 meses, como también déficit en memoria a corto plazo a los cuatro años de edad. Un informe más reciente indicaba que algunos déficit observados en edades tempranas no eran aparentes en las edades 2, 4, o 5 años) Gladen y Rogan, 1991).
En un reciente informe en el New England Journal of Medicine, Jacobson y Jacobson (1996) afirman que la exposición fetal al PCB de las madres que comían pescados contaminados de los Grandes Lagos durante el embarazo estaba asociada con efectos en el desarrollo del sistema nervioso y déficit en la performance intelectual en bebés y niños, efectos que pueden persistir más tarde en la juventud. Estos efectos fueron correlacionados con exposición prenatal (Jacobson y Jacobson, 1996), pero no con la exposición post nacimiento vía leche materna (Jacobson et al., 1990a,b) Los hallazgos del NEJM son inconsistentes con los estudios que no hallaron relación entre la exposición materna a los PCB y el peso de nacimiento de los niños, o la circunferencia de la cabeza (Fein et al., 1984; Rogan et al., 1986).
Las concentraciones de PCB en sangre de las madres en el estudio de Jacobson (1996) fueron sólo ligeramente mayores que los niveles en sangre de madres que no habían comido pescado contaminado, y estaba dentro del rango de niveles de PCB en sangre reportados para toda la población de Norteamérica. Si dichos niveles infinitesimales pudiesen realmente afectar el desarrollo intelectual en bebés y niños, debería haber alguna evidencia de extenso déficit intelectual entre los niños de Estados Unidos. Claramente, no existe ninguna evidencia de dicho fenómeno.
Varios problemas metodológicos cuestionan la validez de los hallazgos del estudio de Jacobson. Por ejemplo, la evaluación de la exposición de las madres estaba basado en estimaciones materiales del consumo de pescado durante los previos seis años, un método notoriamente poco confiable (como fue demostrado en este caso por la baja correlación entre las estimaciones de consumo de pescado y PCB en el suero del cordón umbilical) (Paneth, 1991; Seegal, 1996). Los niveles de PCB en las muestras de suero de los cordones umbilicales estaban por debajo del límite de nivel de detección en más de la mitad de las muestras obtenidas; el método usado para asignar niveles de PCB a esos niños no es nada claro. Esto arroja dudas sobre las afirmaciones de los investigadores de una relación dependiente de la dosis entre el PCB del suero de los cordones fetales y los puntos finales de comportamiento (Seegal, 1996).
Aunque los Jacobson afirman haber controlado los diversos factores que influencian el desarrollo intelectual, ellos no pudieron tener control sobre todos los posibles factores ambientales, sociales, económicos, y genéticos que pueden afectar el desarrollo intelectual. Los críticos del estudio han afirmado también que el pequeño número de sujetos del grupo de control puede haber limitado la capacidad de los métodos estadísticos para controlar potenciales elementos de confusión, tales como el consumo materno de alcohol y peso corporal pre-embarazo (Seegal, 1996; Schantz, 1996). El consumo de alcohol y el peso corporal son determinantes del peso del recién nacido, independiente de la exposición a los PCB, y el consumo de alcohol está asociado con las posibilidades cognitivas del niño (Schantz, 1996).
En todos los estudios de consumo de pescado contaminado, existieron significativos factores de confusión, tales como la presencia de metilo mercúrico, PCDF, PCDD, DDT, y otros pesticidas organoclorados (Foster, 1995). Aunque algunos de estas sustancias químicas, específicamente los PCDD, pueden ocurrir como productos de descomposición de los PCB bajo condiciones de fuerte calor, también están presentes en el ambiente a partir de fuentes sin relación alguna con el uso de los PCB. Muchos de estos químicos son tóxicos reproductivos y del desarrollo, y por consiguiente los efectos adversos reportados en este estudio, no pueden ser atribuidos específicamente a los PCB. De hecho, los mismos Jacobson han declarado: Es posible que los déficit de comportamiento asociados con el consumo de pescado se deben a la presencia de otras toxinas, además del PCB, en el mismo pescado contaminado (Jacobson, et al., 1984).
Además, los investigadores no hallaron una significativa asociación entre el PCB en la leche materna (que era cientos de veces mayor que las concentraciones de PCB en la sangre materna) y el deterioro mental. Aunque los Jacobson explican esta anomalía al sugerir que el cerebro del feto en desarrollo es extremadamente sensible a los efectos del PCB, en realidad el desarrollo del cerebro continúa durante muchos años; algunas áreas del cerebro son relativamente maduras al tiempo del nacimiento, mientras que otras sufren un considerable crecimiento después del mismo (Schantz, 1996). Por cierto, la leche materna conteniendo trazas de PCB podrían representar una exposición potencialmente mucho mayor para los bebés que la exposición transplacéntica.
Mientras que estudios en animales de diversas especies han demostrado que la exposición materna a los PCB puede llevar a adversos efectos reproductivos y de desarrollo (ATSDR, 1996; Gray et al., 1993; Arnold et al., 1990; 1993a,b; Meserve et al., 1992), se necesita de más investigación para determinar que los PCB actúan solos o como cofactores para causar deterioro en el desarrollo de los seres humanos.
5.4 ¿Perturban los PCB al Sistema Endocrino Humano?
La disrupción endocrina (hormonal) como indicador mensurable de toxicidad es un tema relativamente nuevo que está recibiendo mucha atención. Algunos científicos han hecho la hipótesis que los problemas de salud relacionados con las hormonas ocurren a causa de los efectos disruptores de trazas de contaminantes químicos en el sistema endocrino. Esto fue ampliamente publicitado en 1988 como un principio general, con la liberación de 'Nuestro Futuro Robado' (Colburn et al., 1996). Los autores sugerían que algunos químicos, actuando como disruptores hormonales, podrían conducir a la infertilidad, algunos cánceres (por ej,: cánceres de mama, próstata, testículos, ovarios, y útero), y otros desórdenes hormonales.
Los estrógenos son producidos tanto en machos como en las hembras, pero a un nivel mayor en las hembras. En los machos, los estrógenos son producidos a partir de la testosterona y se cree que están involucrados en la creación de la esperma. En las hembras, la producción de estrógenos cesa después de la menopausia. También se encuentran estrógenos naturales en las plantas (fitoestrógenos) y son consecuentemente consumidos en la dieta. Las ligninas (una familia de fitoestrógenos) pueden ser estrogénicos o antiestrogénicos en su naturalezam dependiendo del ambiente hormonal y el asunto del blanco específico. Algunos fitoestrógenos están bajo investigación como agentes anticancerígenos (Aldercreutz et al., 1995).
La evidencia de los efectos de estrógenos ambientales sobre la vida silvestre permanece siendo débil y circunstancial. Por ejemplo, Nuestro Futuro Robado sugiere que los químicos en el ambiente, actuando como disruptores endocrinos, podrían ser los responsables de la producción de animales hembra a partir de huevos que contienen embriones machos. Sin embargo, se ha demostrado que el mismo cambio de sexo puede ocurrir en tortugas cuando los huevos que contienen embriones machos son incubados a dos grados Centígrados más alto que lo normal (Crews et al., 1984). Por ello, es claro que algunos efectos han sido prematuramente atribuidos a la disrupción endocrina basado en evidencia incompleta.
La actividad hormonal descrita en Nuestro Futuro Robado ha sido atribuida con frecuencia a la actividad estrogénica (acentuamiento de los estrógenos) o antiestrogénica (bloqueo de los estrógenos). No obstante, la disrupción endocrina no es un punto final per se, pero podrían ser usados para describir un mecanismo a través del cual la toxicidad podría ocurrir y debería ser usada en esta capacidad.
El Dr. Stepehen Safe, un extensamente reconocido experto en la toxicidad de compuestos organoclorados, cree que los PCB no son estrogénicos pero sus metabolitos tienen una débil actividad estrogénica (Safe, 1995). En verdad, mezclas de PCB pueden exhibir actividad tanto estrogénica como antiestrogénica. El Dr. Safe ha estimado que la actividad estrogénica en la dieta promedio es unas 40 millones de veces más grande que la de los estrógenos ambientales. Él ha caracterizado a la hipótesis de que los estrógenos ambientales pueden causar un aumento del cáncer de mama o problemas reproductivos masculinos, como carente de prueba y nada plausible.
Muchos estudios han observado altos niveles de organoclorados (PCB y otros compuestos clorados) en la grasa y leche de pacientes de cáncer de mama. La totalidad de la evidencia sobre organolorados sugiere que no hay correlación entre estos compuestos químicos y el cáncer de mama. Key y Reeves (1995) analizaron seis estudios de la relación entre PCB (como también DDT) y el cáncer de mama. La revisión no encontró diferencias en los niveles corporales de cada una de esas sustancias en los pacientes con cáncer y los pacientes libres de cáncer del grupo de control. Otra revisión de la información disponible tampoco apoya la hipótesis de que el DDT o los PCB puedan causar un aumento del riesgo de cáncer (Aalborg et al., 1995).
La complejidad de las mezclas de PCB y sus productos de la degradación térmica han hecho a este grupo de sustancias químicas difíciles de caracterizar en términos de toxicidad. Es importante reconocer que la toxicidad de las mezclas de PCB dependen de la toxicidad de los congéneres individuales de PCB presentes en la mezcla y, por supuesto, de la presencia de otros contaminantes más potentes (Safe, 1994); DeVoogt y Brinkman, 1989). No hay ninguna base científica para suponer que todas las mezclas de PCB tendrán la misma toxicidad; esto está empezando a ser reconocido por las agencias reguladoras tales como la EPA. Algunos PCB y sus productos de degradación térmica son mucho más tóxicos que otros. Más aún, las mezclas de PCB degradados térmica o ambientalmente se difieren significativamente en composición y, en consecuencia, en toxicidad, de la mezcla de PCB comercial original (McFarland y Clarke, 1989; Safe, 1990; Borlakoglu, et al., 1990a,b,c; Brown et al., 1987). Además, los estudios hechos para evaluar los riesgos de salud humana han sido complicados por la presencia de otros, conocidos agentes tóxicos, tales como el metilo de mercurio, pesticidas, etc. Por consiguiente, el cuidadoso examen de específicas mezclas contaminantes está evolucionando como una importante herramienta en la calibración de los riesgos de salud (Safe, 1994; EPA, 1991a).
5.5 PCB en Pescados y Otros Alimentos
Los PCB descargados en ríos tienden a concentrarse en sedimentos, y pueden ser tomados por los peces. Como los peces comen a otros peces, o a organismos que viven en el lecho de ríos y lagos, adquieren la carga de PCB presente en sus presas. Los peces son capaces de metabolizar algunos PCB; aquellos no metabolizados o excretados se acumulan en los tejidos grasos. El resultado es la bioacumulación de PCB. Los humanos que consumen pescados también acumularán PCB. Por estas razones, se monitorean a los peces para medir la concentración de PCB en cuerpos de agua contaminados. La FDA ha establecido también un límite de tolerancia de PCB de 2 ppm para filetes de pescado vendidos al público, por encima de los cuales la FDA tomará intervención. Existe también una Base de Datos de Consumo Nacional de Pescado para mantener a los consumidores informados de los niveles de contaminación monitoreados en peces (Nowell y Resck, 1994; FDA, 1988).
Dos estudios de comedores de pescado no han demostrado un directo efecto adverso sobre la salud a partir de los PCB. El Departamento de Salud Pública de Michigan, bajo el patrocinio de la FDA, midió los potenciales efectos sobre la salud de exposiciones a PCB mayores que lo normal debido al consumo de PCB. El estudio involucró a 182 adultos, 105 de los cuales consumieron anualmente más de 26 libras de pescado de los Grandes Lagos. Se observó una significativa correlación entre los niveles de PCB en sangre y la cantidad de pescado consumido. Una evaluación de las historias clínicas y actuales problemas médicos de los sujetos del estudio, sin embargo, no reveló ninguna diferencia entre el grupo de grandes consumidores de pescado y aquellos con menores exposiciones a pescado contaminado con PCB (Departamento de Salud Pública de Michigan, 1975; Humphrey, 1980).
En otro estudio, el Departamento de Servicios de Salud de Connecticut condujo un análisis de muestras de sangre y revisó historias médicas de personas que reportaron haber comido pescado del Río Housatonic. Nuevamente hubo una significativa correlación entre la cantidad de pescado ingerido y los niveles de PCB en sangre, pero ninguna conexión pudo hacerse entre las observaciones clínicas y los niveles de PCB (Beck, 1981).
Los estudios conducidos desde 1980 han demostrado que los niveles de PCB en peces de agua dulce han estado disminuyendo. Los niveles promedios variaron de 0.5 ppm a 1.9 ppm (ATSDR, 1996). En una evaluación de la EPA de 1986-89, los peces de 97% de los sitios contenían 10 ppm de PCB o menos, mientras que un estudio mostró que los peces del 75% de los sitios analizados contenían 1 ppm o menos (Keuhl et al., 1994). Los peces cercanos a sitios industriales altamente contaminados, sin embargo, contienen niveles de PCB mucho más altos.
Según estudios de la FDA, la cantidad de PCB consumida en la dieta ha disminuido de manera sostenida (de casi 7 mg/día en 1971 a menos de 0.1 mg/día en 1988) (Shank, 1991), y la fuente primaria de PCB ha cambiado de pescados a la carne (ATSDR, 1996). Los siguientes límites de tolerancia permitidos por la FDA para alimentos comercializados están actualmente en vigencia:
- 2 ppm en filete de pescado (FDA, 1988)
- 1.5 ppm en grasa de la leche (Fed. Reg., 1979)
- 1.5 ppm en la porción de grasa de productos lácteos manufacturados (Fed. Reg., 1979)
- 3 ppm en aves de corral (Fed. Reg., 1979)
- 0.3 ppm en huevos (Fed. Reg., 1979)
Los niveles medidos en la mayoría de los productos mencionados arriba están muy por debajo de las tolerancias permitidas. En 1992, la FDA estableció un nivel de acción para alimentos manufacturados (la mayoría relativa a carnes rojas) a 3 ppm de PCB detectable en grasa.
6. Evaluación de Riesgo por PCB
Basado en estudios sobre animales, la EPA, ACGIH, IARC, y el NTP han clasificado a los PCB como potenciales cancerígenos para los humanos (probable cancerígeno humano bajo el esquema del peso de la evidencia de la EPA). No existe ninguna evidencia concluyente que implique a los PCB como cancerígeno humano. El criterio de toxicidad (Los RfDs y estimaciones numéricas de potencia del cáncer) publicado por la EPA, usados para cuantificar a los riesgos de cánceres y no-cánceres para los seres humanos, se derivan exclusivamente de estudios sobre animales.
Existe una significativa incerteza subrayando este criterio; es necesaria más investigación científica para mejorar la predicción de riesgos para la salud humana. En 1996, un equipo conjunto de la EPA, ATSDR, y el NTP fue organizado para información específica que reduciría o eliminaría la incerteza en las evaluaciones sobre la salud humana y los PCB (ATSDR, 1996). Más que basar simplemente los valores de riesgo en efecto sobre animales, y suponer que todas las mezclas de PCB son igualmente tóxicas y cancerígenas, este panel ha reconocido que la determinación de la toxicidad de concentraciones específicas de PCB muy pocas veces se obtienen de análisis de muestras del ambiente (suelo, etc), haciendo difícil de evaluar los riesgos de las exposiciones a un PCB en particular.
La EPA recientemente ha intentado enfrentar a otra mayor fuente de incerteza en la evaluación del riesgo de los PCB. Las mezclas comerciales de PCB difieren de las mezclas presentes en el ambiente, tanto en composición como en toxicidad. La EPA está usando ahora criterios de toxicidad específicos al medio de exposición (p. Ej.; suelo, aire, comida) (EPA, 1996b), para tomar cuenta de las diferencias en las mezclas de PCB presentes en estos diferentes medios ambientales. También es notable es la reciente disminución de las estimaciones publicadas por la EPA de la potencia cancerígena del PCB entre 4 y 20 veces menos, reflejando el uso de nueva información científica y una revisada metodología de evaluación de riesgos (EPA, 1996b). Los previamente desarrollados factores de equivalencia tóxica tipo dioxina [Criterio que toma cuenta de las similitudes en la estructura y toxicidad entre ciertos PCB individuales y las dioxinas] serán también incorporados a las evaluaciones de riesgo, cuando sean disponibles concentraciones específicas de PCB. Estos desarrollos en la evaluación de riesgo se basan en información científica actualizada en áreas destacadas por el comité conjunto.
7. Regulaciones de PCB
Hay varias regulaciones que se dirigen a los PCB. El Acta de Control de Sustancias Tóxicas (TSCA) de 1976 prohibió la fabricación, procesado, distribución y uso de los PCB en todos los productos que no estuviesen contenidos herméticamente. Originalmente, la regulación de los PCB era el foco de la TSCA. Desde entonces, la óptica del TSCA ha crecido hasta proveer guía para el ensayo de toxicidad y liberación de otros químicos; sin embargo, los PCB son la única familia química totalmente regulada bajo cualquier acto del gobierno. Esto incluye la regulación de cualquier liberación de PCB al ambiente, incluyendo derrames o goteos accidentales. La Política de Limpieza de Derrames de PCB emitida por el TSCA es la fuente de los niveles de limpieza de PCB basados en riesgos para áreas no restringidas versus áreas restringidas (es decir, áreas que son fácilmente accesibles por el público en general, versus sitios remotos o de difícil acceso) que han sido aplicados para la remediación de sitios contaminados bajo otros programas, tales como el Superfund (EPA, 1987).
Las regulaciones de la EPA requerían que los condensadores en áreas donde la exposición pública podría ocurrir (como postes de compañías eléctricas en los patios) fuesen retirados de servicio para 1988 (Fed. Reg., 1982a,b, 1985). El uso de los condensadores en áreas protegidas tales como campos cercados de las compañías eléctricas - estaba permitido hasta el fin de su vida útil. Bajo el TSCA, se requiere que los dueños y operadores de estas instalaciones informen regularmente sobre la seguridad, uso, y eliminación. La EPA añadió restricciones adicionales (Fed. Reg., 1985) sobre el uso de transformadores que contuviesen PCB (500 ppm o más de PCB en el fluido del dieléctrico) para enfrentar los posibles peligros de fuegos en los equipos eléctricos.
Después de 1990, la mayoría de las regulaciones hicieron foco sobre el rastreo de residuos de PCB y disposición final (EPA, 1991b, 1992a,b). En 1991, la EPA estableció el Máximo Nivel de Contaminante para el agua potable en 0.004 ppm para los adultos y 0.001 ppm para los niños; muchos estados individuales han establecido también normas más severas para el agua potable (EPA, 1994):
En abril de 1996, el Presidente Clinton levantó parcialmente la prohibición sobre la importación de PCB, permitiendo que se abriese la importación de embarques de PCB a los Estados Unidos para su incineración (McTahue, 1996). Canadá respondió en noviembre de 1996 con la extensión de una prohibición a la exportación de residuos de PCB desde Canadá, reflejando la creciente competencia en el negocio de los residuos peligrosos.
8. Las Alternativas a los PCB
Los PCB eran industrialmente importantes debido principalmente a sus características de resistencia al fuego. Existen varias alternativas químicas para los PCB (incluyendo a los fluidos de silicona, fluorocarbonos, hidrocarburos de elevado peso molecular, hidrocarburos clorados de bajo peso molecular, y aceites de alto punto de ebullición y ésteres) que funcionarán en equipos eléctricos. Sin embargo, un transformador fabricado para usar PCB no operará a la misma carga de potencia con un sustituto químico, es decir, tiene que ser bajado de potencia (Fed. Reg. 1985). Tal transformador se hace menos eficiente, resultando en un aumento del costo operativo, como también un agregado riesgo de incendio. Se deben implementar medidas precautorias para asegurar la seguridad contra incendios y adecuada disposición de los residuos. Claramente, el cambio de PCB a agentes alternativos ha involucrado un intercambio, y no la eliminación, de riesgos para la salud y la seguridad.
9. ¿Qué estamos Haciendo Para Limpiar los PCB? Algunos Ejemplos
Existen actualmente esfuerzos para limpiar a los PCB del ambiente. La mayor parte de los sitios han sido limpiados mediante la excavación y disposición final en rellenos aprobados por la EPA, aunque la incineración la incineración de suelos. Estos esfuerzos, junto a la prohibición de la manufactura de PCB, aseguran que la exposición a los PCB continuará descendiendo en los Estados Unidos. La EPA está actualmente supervisando varios lugares del Superfund que contienen significante niveles de PCB, donde la remediación completa ha sido retrasada por varios factores, incluyendo la falta de tecnología adecuada (un problema particular para los sedimentos) y la oposición local para rellenos o incineradores. Antes de la misma remediación pueda ocurrir, se deben hacer investigaciones de remediación y estudios de factibilidad (incluyendo análisis de costos).
Un proceso como ese está en marcha en el Río Hudson, fuertemente contaminado a causa de descargas industriales. Desde 1947 hasta 1977, se descargaron en el Río Hudson más de 500.000 libras de PCB, bajo permiso, por parte de dos plantas de la General Electric (GE) fabricantes de condensadores en Fort Edward y Hudson Falls, New York. El Departamento de Conservación Ambiental del Estado de Nueva York ha gastado más de 3 millones de dólares para investigar la extensión de la contaminación con PCB del río. El estudio identificó 40 puntos calientes en el Río Hudson superior (un punto caliente se define como sedimento que contiene 50 ppm o más de PCB). En 1992, el informe Fase I de la EPA de la investigación de remediación reveló gotas de PCB en el fracturado lecho del río rocoso (muy profundamente en el río) que actúa como una fuente adicional de PCB filtrándose al río. La concentración medida de PCB en estos lugares es tan alto como 44.000 ppm.
Se sugirió inicialmente (y es mantenido por la GE) que dejando tranquilos a los ríos y lechos contaminados permitiría la restauración natural y remediación de las aguas cargadas de PCB. En la parte superior del Río Hudson ha ocurrido una decoloración bacterial de PCB en los sedimentos enterrados (Brown et al., 1987), pero actualmente no hay manera práctica de acelerar este proceso. Los marcos de tiempo para la remediación natural fueron estimados en 20 a 30 años más que para la remediación activa, pero se argumentó que la remediación natural sería más barata y menos disruptiva para el ecosistema que las medidas de remediación tales como el dragado. Sin embargo, cualquier remediación que no enfrente el problema de la continuada filtración de las gotas de PCB del lecho rocoso fracturado debajo de la porción dragable del Río Hudson, no será efectiva en el largo plazo.
Mientras que la remediación activa se consideró necesaria, se están investigando alternativas al dragado del lecho del río. La GE ha construido una planta de tratamiento en Hudson Falls para reducir las concentraciones de PCB a 65 partes por billón (ppb) antes de su liberación a la parte principal del río. En estos momentos, (1997) la EPA está completando la Fase II de la investigación de remediación; se espera que los informes sean publicados para la primavera de 1997. Esto será seguido de los informes de la final Fase III que incluirán una propuesta de método para la remediación, acercamientos alternativos, y un análisis de costos. Hasta que esto sea completado, no habrá ninguna remediación regulada del Río Hudson.
En Massachusetts se están conduciendo estudios concernientes a la remoción de PCB del puerto de New Bedford. Se ha construido una instalación de tratamiento de aguas residuales, y se han producido algunos dragados en los puntos calientes del sedimento del puerto. Sin embargo, aún se están diseñando y construyendo las remediaciones.
En Waukegan Harbor del Lago Michigan, donde se descargaron PCB de diversas fuentes, ya se han dragado más de 1 millón de libras de sedimento contaminado. La EPA y grupos consejeros de ciudadanos están trabajando juntos para planear nuevas acciones incluyendo una evaluación de la efectividad del dragado y restauración de los usos perjudicados del puerto. También está bajo investigación las alternativas al dragado debido a la preocupación por la recontaminación del agua por la agitación de los sedimentos, y la preocupación del público por la disposición final e incineración de los materiales dragados. De hecho, el millón de libras de sedimentos dragados del puerto Waukegan están actualmente en almacenamiento aislado. Se han adjudicado seis millones de dólares durante seis años para continuar la limpieza del Waukegan Harbor.
Las técnicas de remediación y tecnologías de disposición continúan evolucionando. Muchos enfrentamientos han sido ensayados pero ninguno ha emergido como una solución técnica y económicamente viable para la miríada de situaciones ambientales encontradas. Un útil método para la limpieza del agua no será probablemente efectiva para el suelo. Los PCB altamente clorados no serán tan rápidamente descompuestos como los menos clorados. Este tipo de factores contribuyen a los retos para la remediación efectiva y eficiente en costos de los sitios contaminados con PCB. La degradación bacteriana o biodegradación de los PCB en suelos y sedimentos es una tecnología potencialmente útil que está recibiendo mucha atención (Shannon, 1996; Brenner et al., 1994; Furukawa, 2994, Abramowicz, 1994; Anon., 1997). Los resultados preliminares de la degradación de muestras de suelo, incluyendo las tomadas del Río Hudson, son prometedoras. También está siendo investigada el acercamiento manta térmica, en donde el suelo es calentado desde la superficie hacia abajo y los PCB volatilizados son removidos bajo vacío.
20. ¿Cuánto Nos Está Costando Todo Esto?
El reemplazo, monitoreo y disposición final de los PCB ha costado una sustancial cantidad de dinero (estimaciones suministradas en 1982 y 1985 en el Federal Register notices totalizaron casi $970 millones), en relación a las siguientes actividades. (Fed. Reg., 1982a, 1985)
- Inspección de transformadores (fuera de aquellos en instalaciones de alimentos y comidas)
- Remoción de condensadores elegidos en 1988;
- Reemplazo de equipos eléctricos con PCB en establecimientos de alimentos y comidas de 1985.
- Suministro de acentuada seguridad eléctrica;
- Etiquetado y registro de transformadores con PCB;
- Remoción de transformadores de alto voltaje y suministro de protección eléctrica para otros transformadores que permanecen (Fed. Reg., 1985)
También hubieron otros costos. Por ejemplo, la Compañía de Iluminación Eléctrica de Cleveland espera que un aumento de costos de $9 millones sea transferido al publico debido al requerido temprano reemplazo de todos sus transformadores y condensadores conteniendo PCB en su sistema. La presión pública en San Francisco provocó que la Pacific Gas & Electric Company accediese a un temprano reemplazo de condensadores a un costo de $12 millones.
Obviamente, estos costos de inspección y reemplazo para las compañías eléctricas aparecen en las facturas de los consumidores. El costo para la industria privada de inspeccionar sus equipos y reemplazar condensadores y transformadores contribuyen a un mayor precio de los productos. Sin embargo, los costos de reemplazo y mantenimiento de equipos palidecen ante los costos de limpieza de derrames de PCB y sitios donde fueron almacenados. En los años 89 y más allá, la mayoría de los costos irá a la remediación de sitios severamente contaminados con PCB, tales como el Río Hudson, New Bedford, y el Lago Michigan. La EPA ha estimado recientemente la cantidad total de residuos de PCB que permanecen en espera de remediación, en 525 millones de toneladas (Agarwal, 1994); suponiendo un costo promedio de $250 por tonelada para vaciadero, y $500 por tonelada para incineración, el costo de eliminación de esta cantidad de residuo es una asombrosa $131 a $263 mil millones de dólares.
Muchos factores influenciarán el costo de tal limpieza, incluyendo la ubicación de PCB (en agua, suelo, sedimentos, lecho rocoso, etc); condiciones aeróbicas (expuestos al aire) versus anaeróbicas; PCB específicos presentes (los PCB altamente clorados son generalmente más difícil de degradar que los PCB menos clorados).; y métodos específicos de tratamiento, incluyendo desarrollos en biorremediación (degradación bacteriana) y otras nuevas técnicas de remediación.
11. RESUMEN y Recomendaciones
Aunque los PCB son persistentes en el ambiente y son almacenados en la grasa del cuerpo, los niveles de PCB en peces, otros alimentos y sangre humana están disminuyendo (ATSDR, 2996). No hay una evidencia concluyente sobre que los niveles de fondo en la población en general, o aún los muy elevados niveles que ocurrieron entre algunos grupos ocupacionales, dieran por resultado efectos agudos o cancerígenos. En los seres humanos, los únicos efectos que están fuertemente asociados con las exposiciones a los PCB son problemas de ojos y piel (cloroacné, cambios en la pigmentación de la piel, e irritación crónica de piel y ojos). Estos efectos han sido reportados únicamente a continuación de elevadas exposiciones a los PCB, junto con otras sustancias químicas. Ninguno de estos efectos fueron observados en poblaciones expuestas a través del consumo de pescado. El cáncer no ha sido correlacionado con niveles de exposición a los PCB, y por consecuencia, no pueden ser atribuidos a la exposición a los PCB.
Los PCB han sido detectados en tejidos del cuerpo; aún así, la presencia de una sustancia química en un tejido no indica, necesariamente, un peligro para la salud. Recientes informes sugieren una correlación entre la exposición a los PCB in utero (a partir del consumo de pescado contaminado con PCB por la madre) y un perjudicado desarrollo intelectual, no están apoyados por otros estudios de exposición prenatal, y están limitados por deficiencias en la evaluación de la exposición y control de variables de confusión. Tampoco hay evidencia de un deterioro a escala nacional del desarrollo intelectual de los niños, aún cuando los niveles de PCB en sangre de las madres a los cuales supuestamente ocurrieron son apenas ligeramente más altos que los niveles en sangre de mujeres que no consumieron pescado contaminado, y está dentro del rango de niveles de PCB normales para los Estados Unidos.
La disminución del uso de PCB, una prohibición de fabricación, y los esfuerzos de limpieza han sido exitosos al reducir significativamente la exposición pública. Cualquier riesgo potencial a una exposición a PCB debería seguir una tendencia similar. La ACSH recomienda las siguientes acciones:
- La industria y el gobierno deberían enfocar en el desarrollo de noveles y efectivas tecnologías de remediación y disposición final, para los sitios particularmente difíciles de limpiar, tales como los lechos de ríos.
- Continuar la investigación científica que pueda ser usada para mejorar los análisis de riesgos para la salud por ejemplo, es necesaria la elaboración adicional de la toxicidad de PCB específicos y mezclas de PCB halladas en el ambiente, para reducir la incerteza asociada con la exposición a los PCB y efectos sobre la salud en los humanos.
Referencias
- Abramowicz, D.A. (1994). Aerobic PCB biodegradation and anaerobic PCB dechlorination in the environment. Res. Microbiol. 145(1), 42.
- Agarwal, N. (December 6, 1994). Final Report: Costs of Compliance with the Proposed Amendments to the PCB Regulation. U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics, Regulatory Impacts Branch.
- Agency for Toxic Substances and Disease Registry (ATSDR). (1996). Toxicological Profile For Polychlorinated Biphenyls. Final. U.S. Department of Health and Human Services.
- Ahlborg, U.G., Lipworth, L., Titus-Ernstoff, C.C., et al. (1995). Organochlorine compounds in relation to breast cancer, endometrial cancer, and endometriosis: an assessment of the biological and epidemiological evidence. Crit. Rev. Toxicol. 25, 463.
- Aldercreutz, C.H., Goldin, B.R., Gorbach, S.L., et al. (1995). Soybean phytoestrogen intake and cancer risk. J. Nutr. 125 (Suppl 3), 757S.
- American Conference of Governmental Industrial Hygienists (ACGIH). Threshold Limit Values for Chemical Substances and Physical Agents, 1996.
- (January 31, 1997). PCB in sediment. Envir. Sci. Technol. News 97, 29.
- Arnold, D.L., Bryce, F., Stapley, R., et al. (1993a).Toxicological consequences of Aroclor 1254 ingestion by female rhesus monkeys. Part 1A. Prebreeding phase: clinical health findings. Food Chem. Toxicol. 31(11), 799.
- Arnold, D.L., Bryce, F., Stapley, R., et al. (1993b).Toxicological consequences of Aroclor 1254 ingestion by female rhesus monkeys. Part 1B. Prebreeding phase: clinical and analytical laboratory findings. Food Chem. Toxicol. 31(11), 811.
- Arnold, D.L., Mes, J., Bryce, F., et al. (1990). A pilot study on the effects of Aroclor 1254 ingestion by rhesus and cynomologous monkeys as a model for human ingestion of PCB. Food Chem. Toxicol. 28, 847.
- Atlas, E., Giam, C.S. (1981). Global transport of organic pollutants: ambient concentrations in remote marine atmosphere. Science 211, 163.
- Bacon, C.E., Jarman, W.M., Costa, D.P. (1992). Organochlorine and polychlorinated bophenyl levels in pinniped milk from the Arctic, the Antarctic, California, and Australia. Chemosphere 24, 779.
- Ballschmitter, K. (1991). Global distribution of organic compunds. Environ. Carcinogen Rev. 9, 1.
- Bandiera, S., Farrell, K., Mason, G., Kelley, M., Romkes, M., Bannister, R., and Safe, S. (1984). Comparative toxicities of the polychlorinated dibenzofuran (PCDF) and biphenyl (PCB) mixtures which persist in Yusho victims, Chemosphere 13, 507.
- G.J. (1981). Housatonic River PCB study. Statistical analysis prepared under contract from the Connecticut State Department of Health Services.
- Bertazzi, P.A., Riboldi, L., Pesatori, A., et al. (1987). Cancer mortality of capacitor manufacturing workers. Am. J. Indust. Med. 11, 165.
- Borlakoglu, J.T., Wilkins, J.P.G., Walker, C.H., and Dils, R.R. (1990a). Polychlorinated biphenyls (PCB) in fish-eating sea birds. I. Molecular features of PCB isomers and congeners in adipose tissue of male and female razorbills (Alca tarda) of British and Irish coastal waters. Comp. Biochem. Physiol. 97, 151.
- Borlakoglu, J.T., Wilkins, J.P.G., Walker, C.H., and Dils, R.R. (1990b). Polychlorinated biphenyls (PCB) in fish-eating sea birds. II. Molecular features of PCB isomers and congeners in adipose tissue of male and female puffins (Fractercula arctica), guilemots (Uria aalge), shags (Phalacrocorax aristotelis) and cormorants (Phalacrocorax carbo) of British and Irish coastal waters. Comp. Biochem. Physiol. 97, 161. Borlakoglu, J.T., Wilkins, J.P.G., Walker, C.H., and Dils, R.R. (1990c). Polychlorinated biphenyls (PCB) in fish-eating sea birds. III. Molecular features and metabolic interpretations of PCB isomers and congeners in adipose tissues. Comp. Biochem. Physiol. 97, 173.
- Brenner, V., Arsendorf, J.J., Focht, D.D. (1994). Genetic construction of PCB degraders. Biodegradation 5(3-4), 289.
- Brown, B.R. (1987). Studies on inhalation anesthetic hepatotoxicity. Crisp Data Base, National Institutes of Health.
- Brown, D.P., Jones, M. (1981). Mortality and industrial hygiene study of workers exposed to polychlorinated biphenyls. Arch. Environ. Health 36, 120.
- Brown, J.R. Jr., Bedard, D.L., Brennan, M.J., Carnahan, J.C., Feng, H., and Wagner, R.E. (1987). Polychlorinated biphenyl dechlorination in aquatic sediments. Science 236, 709-712.
- Brunner, M.J., Sullivan, T.M., Singer, A.W., et al. (1996). An Assessment of the Chronic Toxicity and Oncogenicity of Aroclor-1016, Aroclor-1242, Aroclor-1254, and Aroclor-1260 Administered in Diet to Rats. Columbus: Batelle Study No. SC920192, Chronic toxicity and oncogenicity report.
- Buser, H.R., Rappe, C., Gara, A. (1978). Polychlorinated dibenzofurans (PCDFs) found in Yusho oil and in used Japanese PCB. Chemosphere 5, 439.
- P.H., Chang, K.T., Lu, Y.D. (1981). Polychlorinated biphenyls and polychlorinated dibenzofurans in the toxic rice-bran oil that caused PCB poisoning in Taichung. Bull. Envir. Contam. Toxicol. 26, 489.
- Y.-C., Guo, Y.-L., Hsu, C.-C., and Rogan, W.J. (1992). Cognitive development of Yu-Cheng ("oil disease") children prenatally exposed to heat-degraded PCB. JAMA 268, 3213.
- Colburn, T., Dumanoski, D., Myers, J.P. (1996). Our Stolen Future. Penguin Group, New York.
- Crews, D., Bergeron, J.M., Bull, J.J., et al. (1994). Temperature-dependent sex determination in reptiles: proximate mechanisms, ultimate outcomes, and practical applications. Dev. Gen. 15(3), 297.
- Davidorf, F.H., Knupp, J.A. (1979). Epidemiology of ocular melanoma. Incidence and geographic relationship in Ohio (1967-1977). Ohio State Med J. 75, 561.
- DeVoogt, P., Brinkman, U.A. (1989). Production properties and usage of polychlorinated biphenyls. In Halogenated Biphenyls, Terphenyls, Naphthalenes, Dibenzodioxins, And Related Products. 2nd ed. (R.D. Kimbrough, A.A. Jensen, Eds.), pp 3-45, Elsevier Science Publishers, Amsterdam.
- Falck, F., Ricci, A., Wolff, M.S., Godbold, J., and Deckers, P. (1992). Pesticides and polychlorinated biphenyl residues in human breast lipids and their relation to breast cancer. Arch. Environ. Health 47, 143.
- Reg. 44, 38340, June 29, 1979.
- Reg. 47, 437342, August 25, 1982a.
- Reg. 47, 46980, October 21, 1982b.
- Reg. 50, 29170, July 17, 1985.
- Feeley, M.M. (1996). World Health Organization Group on the Assessment of Health Risks for Infants from Exposure ro PCDDs, PCDFs, and PCB. Proceedings from 16th Symposium on Chlorinated Dioxins and Related Compounds: Organohalogen Compounds, Amsterdam, Vol. 30, p.276.
- G.G., Jacobson, J.L., Jacobson, S.W., et al. (1984). Prenatal exposure to polychlorinated biphenyls: Effects on birth size and gestation age. J. Pediatr. 105, 315.
- Foster, W.G. (1995). The reproductive toxicology of Great Lakes contaminants. Envir. Health Perspect. 103 (Suppl 9), 63.
- Furukawa, K. (1994). Molecular genetics and evolutionary relationship of PCB-degrading bacteria. Biodegradation 5 (3-4), 289.
- Gladen, B.C., Rogan, W.J. (1991). Effects of perinatal polychlorinated biphenyls and dichlorodiphenyl dichloroethene on later development. J. Pediatr. 119, 58.
- Gladen, B.C., Rogan, W.J., Hardy, P., Thullen, J., Tingelstad, J., Tully, M. (1988). Development after exposure to polychlorinated biphenyls and dichlorodiphenyl dichloroethene transplacentally through human milk. J. Pediatr. 113, 991-995.
- L.E. Jr., Ostby, J., Marshall, R., et al. (1993). Reproductive and thyroid effects of low-level polychlorinated biphenyl (Aroclor 1254) exposure. Fund. Appl. Toxicol. 20(3), 288.
- Gustavsson, P., Hogstedt, C., Rappe, C. (1986). Short-term mortality and cancer incidence in capacitor manufacturing workers exposed to polychlorinated biphenyls. Am. J. Indust. Med. 10, 341.
- Hsieh, S.-F., Yen, Y.-Y., Lan, S.-J., Hsieh, C.-C., Lee, C.-H., Ko, Y.-C. (1996). A cohort study on mortality and exposure to polychlorinated biphenyls. Arch. Envir. Health 51, 417-424.
- S.-T., Ma, C.-I., Hsu, S.K.-H., Wu, S.-S., Hsu, N.H.-M., Yeh, C.-C., Wu, S.-B. (1985). Envir. Health Perspect. 59, 5-10. As cited in Kuratsune et al. 1972.
- Humphrey, H.E.B. (1980). Evaluation of humans exposed to halogenated biphenyls. Am. Chem. Soc. Div. Envir. Chem. Reprints 20, 272.
- Hutzinger, et al. (1985). Formation of polychlorinated dibenzofurans and dioxins during combustion, electrical equipment fires, and PCB incineration. Environ. Health Persp. 60, 3.
- Ikeda, M., Kuratsune, M., Nakamura, Y., Hirohata, T. (1985). Fukuoka Acta Med. 76: 126-131 (in Japanese). As cited in Kuratsune et al. 1972.
- International Agency for Research on Cancer (IARC). (1987). IARC Monographs on the Evaluation of the Carcinogenic Risk of Chemicals to Humans. Suppl 7: Update of IARC Mongraphs Volumes 1-42. World Health Organization, Lyons, France.
- Jacobson, S.W., Fein, G.G., Jacobson, J.L., et al. (1985). The effect of intrauterine PCB exposure on visual recognition memory. Child Dev. 56, 856.
- Jacobson, J.L., Jacobson, S.W. (1996). Intellectual impairment in children exposed to polychlorinated biphenyls in utero. New Engl. J. Med. 335, 783.
- Jacobson, J., Jacobson, S., Fein, G., Schwartz, P., Dowles, J. (1984). Prenatal test of an environmental toxin: a test of the multiple effects model. Devel. Psychol. 20,523-532.
- Jacobson, J.L., Jacobson, S.W., Humphrey, H.E.B. (1990a). Effects of in utero exposure to polychlorinated biphenyls and related contaminants on cognitive functioning in young children. J. Pediatr. 116, 38.
- Jacobson, J.L., Jacobson, S.W., Humphrey, H.E.B. (1990b). Effects of exposure to PCB and related compounds on growth and activity in children. Neurotoxicol. Teratol. 12, 319.
- Jensen, S. (1966). Report of a new chemical hazard. New Sci. 32, 612.
- Jensen, S. (1972). The PCB story. Amnio 1, 45.
- Kashimoto, T., Miyata, H., Kunita, S., Tung, T.-C., Hsu, S.-T., Chang, K.-J., et al. (1981). Role of polychlorinated dibenzofuran in Yusho (PCB poisoning). Arch. Envir. Health 36(6), 321.
- Kashimoto, T., Miyatu, H. (1986). Differences between Yusho and other kinds of poisoning involving only PCB. Chapter 1 in PCB in the Environment, Vol. III (J.S. Ward, Ed.), CRC Press.
- Keuhl, D.W., Haebler, C., Potter, C. (1994). Coplanar PCB and metal residues in dolphins from the US Atlantic coast including Altlantic bottlenose obtained during the 1987/88 mass mortality. Chemosphere 28, 1245.
- T., Reeves, G. (1995). Organochlorides in the environment and breast cancer. Br. Med. J. 308, 1520.
- Kihlstrom, J.E., Johansson, A., Ahlbom, J., et al. (1992). Effects of PCB and different fractions of PCB on the reproduction of the mink mustela-vison. Ambio 21(8), 563.
- Krishnan, V., Safe, S. (1993). Polychlorinated biphenyls (PCB), dibenzo-p-dioxins (PCDDs), and dibenzofurans (PCDFs) as antiestrogens in MCF-7 human breast cancer cells: quantitative structure-activity relationships. Toxicol. Appl. Pharmacol. 120, 55.
- Kunita, N., Kashimoto, T., Miyata, H., Fukushima, S., Hori, S., and Obana, H. (1984). Causal agents of Yusho. Am. J. Indust. Med. 5, 45.
- Kuratsune, M. (1989). Yusho, with reference to Yu-Cheng. Chapter 13 in Halogenated Biphenyls, Terphenyls, Naphthalenes, Dibenzodioxins, and Related Products. (R.D. Kimbrough and A.A. Jensen, Eds.), pp 381-400, Elsevier, Amsterdam.
- Kuratsune, M., Yoshimura, T., Matsuzaka, J., Yamaguchi, A. (1972). Epidemiologic study on Yusho, a poisoning caused by ingestion of rice oil contaminated with a commercial brand of polychlorinated biphenyls. Envir. Health Perspect. 1, 119.
- Lawton, R.E., Ross, M.R., Feingold, J., Brown, J.F. (1985). Effects of PCB exposure on biochemical and hematological findings in capacitor workers. Envir. Health Perspect. 60, 165-184.
- McFarland, V.A., Clarke, J.U. (1989). Environmental occurrence, abundance, and potential toxicity of polychlorinated biphenyl congeners: Considerations for a congener-specific analysis. Environ. Health Perspect. 81, 225.
- McTague, J. (April 8, 1996). D.C. Current: Carcinogen in demand. Barrons.
- Meserve, L.A., Murray, B.A., Landis, J.A. (1992). Influence of maternal ingestion of Aroclor 1254® (PCB) or FireMaster BP-6® (PBB) on unstimulated and stimulated corticosterone levels in young rats. Bull. Env. Contam. Toxicol. 48(5), 715.
- Michigan Department of Public Health (1975). Final Report on FDA Contract 73-2209, Evaluation of Changes in the Level of Polychlorinated Biphenyls (PCB) in Human Tissue.
- Miyata, H., Fukushima, S., Kashimoto, T., and Kunita, N. (1985). PCB, PCQs, and PCDFs in the tissues of Yusho and Yu-Cheng patients. Environ. Health Perspect. 59, 67.
Miyata, H., Kashimoto, T., and Kunita, N. (1977). Detection and determination of polychlorinated dibenzofurans in normal human tissues and Kanemi rice oils caused "Kanemi Yusho" (in Japanese). J. Food Hyg. Soc. Jpn. 19, 260.
- National Institute of Occupational Safety and Health (NIOSH). (1977). Criteria For a Recommended Standard: Occupational Exposure to Polychlorinated Biphenyls (PCB). NIOSH publ 77-225. Rockville, MD: US Department of Health, Education, and Welfare, Public Health Service, Centers for Disease Control.
- National Toxicology Program (NTP). (1989). Fifth Annual Report on Carcinogens: Summary 1989. NTP 89-239. Research Triangle Park, North Carolina: USDHHS, 239: 242.
- Nowell, L.H., Resck, E.A. (1994). National standards and guidelines for pesticides in water, sediment, and aquatic organisms: application to water-quality assessments. Rev. Env. Contam. Tox. 140, 1.
- Paneth, N. (1991). Human reproduction after eating PCB-contaminated fish. Health Envir. Digest 5, 2-5.
- Rogan, W.J. (1989). Yu-Cheng. Chapter 14 in Halogenated Biphenyls, Terphenyls, Naphthalenes, Dibenzodioxins, and Related Products. (R.D. Kimbrough and A.A. Jensen, Eds.), pp 401-415, Elsevier, Amsterdam.
- Rogan, W.J., Gladen, B.C., McKinney, J.D., Carreras, R.N., Hardy, P., Thullen, J., Tingelstad, J., and Tully, M. (1986). Polychlorinated biphenyls (PCB) and dichlorodiphenyl dichloroethene (DDE) in human milk: Effects on growth, morbidity, and duration of lactation. Am. J. Public Health 77, 1294-1297.
- Rogan, W.J., Gladen, B.C., McKinney, J.D., Carreras, N., Hardy, P., Thullen, J., Tinglestad, J., and Tully, M. (1988). Congenital poisoning by polychlorinated biphenyls and their contaminants in Taiwan. Science 241, 334.
- Rosenman, K.D. (1992). Dioxin, polychlorinated biphenyls, and dibenzofurans. In Environmental and Occupational Medicine. ((W.N. Rom, Ed.), pp 929-933, Little, Brown and Company, Boston.
- S.H. (1990). Polychlorinated biphenyls (PCB), dibenzo-p-dioxins (PCDDs), dibenzofurans (PCDFs), and related compounds: Environmental and mechanistic considerations which support the development of toxic equivalency factors (TEFs). Crit. Rev. Toxicol. 21, 51.
- S.H. (1994). Polychlorinated biphenyls (PCB): Environmental impact, biochemical and toxic responses, and implications for risk assessment. Crit. Rev. Toxicol. 24(2), 87.
- S.H. (1995). Environmental and dietary estrogens and human health: Is there a problem? Envir. Health Perspect. 103, 346.
- Schantz, S.L. (1996). Developmental neurotoxicity of PCB in humans: what do we know and where do we go from here? Neurotox. Teratol. 18,217-227.
- Seegal, R.F. (1996). Epidemiological and laboratory evidence of PCB-induced neurotoxicity. Crit. Rev. Toxicol. 26, 709-737.
- Shalat, S.L., True, L.D., Fleming, L.E., et al. (1989). Kidney cancer in utility workers exposed to polychlorinated biphenyls (PCB). Br. J. Indust. Med. 46, 823.
- Shank, F., October 2, 1991. Statement before the Committee on Governmental Affairs, U.S. Senate. GAO/PEMD-92-3.
- Shannon, D. (1996). Keep developing PCB and dioxin treatments, GAO report says. Env. Sci. Technol. 30, 114A.
- Smith, A.B. et al. (1981a). Cross Sectional Survey of Two Groups of Workers Occupationally Exposed to Polychlorinated Biphenyls (PCB) in the Maintenance, Repair and Overhaul of Electrical Transformers. National Institute for Occupational Safety and Health, Division of Surveillance, Hazard Evaluations and Field Studies, Cincinnati; and Lipid Research Center, Univ. of Cincinnati Medical Center, Cincinnati.
- Smith, A.B. et al. (1981b). Draft report: Cross-Sectional Survey of a Group of Workers Occupationally Exposed to Polychlorinated Biphenyls (PCB) at an Electrical Equipment Manufacturing Plant. NIOSH, Cincinnati.
- S. Environmental Protection Agency (EPA). (April 2, 1987). Polychlorinated biphenyls spill cleanup policy. Fed. Reg. 52, 10688-10697.
- S. Environmental Protection Agency (EPA). (1991a). Workshop on toxicity equivalency factors for polychlorinated biphenyl congeners. Risk Assessment Forum, Washington DC.
- S. Environmental Protection Agency (EPA). (1991b). National primary drinking water regulations-synthetic organic chemicals and inorganic chemicals; monitoring for unregulated contaminants; national primary drinking water regulations and implementations; national secondary drinking water regulations. 40 CFR parts 141, 142, 143. Fed. Reg. 58, 3526.
- S. Environmental Protection Agency (EPA). (1992a). 40CFR 268.45.
- S. Environmental Protection Agency (EPA). (1992b). 40CFR 279.10.
- S. Environmental Protection Agency (EPA). (1994). Drinking water regulations and health advisories. Office of Water.
- S. Environmental Protection Agency (EPA). (1996a). Integrated Risk Information System (IRIS). Environmental Criteria and Assessment Office, Cincinnati, Ohio.
- S. Environmental Protection Agency (EPA). (1996b). PCB: Cancer Dose-Reponse Assessment and Application to Environmental Mixtures. Report no. EPA 600P-96001F.
- S. Food and Drug Administration (FDA). (1988). Tolerances for unavoidable poisonous or deleterious substances. 21 CFR 109.30.
- Wasserman, M., Wasserman, D., Cucos, S., Miller, H.J. (1979). World PCB map: storage and effects in man and his biologic environment in the 1970s. Ann. NY Acad. Sci. 320, 69.
- Wolff, M.S., Fischbein, A., Thornton, J., Rice, C., Lilis, R., Selikoff I.J. (1982) Body burden of polychlorinated biphenyls among persons employed in capacitor manufacturing. Int. Arch. Occup. Environ. Health 49, 199.
- Health Organization (WHO). (1993). Polychlorinated biphenyls. Environmental Health Criteria 140. Polychlorinated biphenyls and terphenyls. 2nd edition. World Health Organization, Geneva, Switzerland.
- Yassi, A., Tate, R., Fish, D. (1994). Cancer mortality in workers employed at a transformer manufacturing plant. Am. J. Indust. Med. 25(3), 425.
- Yu, M.-L., Hsu, C.-C., Gladen, B.C., and Rogan, W.J. (1991). In utero PCB/PCDF exposure: relation of developmental delay to dysmorphology and dose. Neurotoxicol. Teratol. 13, 195.
Revisores
//\\ Rudolph J. Jaeger, Ph.D., Environmental Medicine, Inc. //\\ Ruth Kava, Ph.D., R.D., American Council on Science an Health //\\ Manfred Kroger, Ph.D., Pennsyvania State University //\\ William M. London, Ed.D., M.P.H., American Council on Science and Health //\\ Frank C. Lu, M.D., Miami, FL
//\\ Ilene R. Danse, M.D., Enviromed Health Services, Inc., University of California at San Francisco, and University of California at Davis //\\ Roger P. Maickel, Ph.D., Purdue University. //\\ John J. McKetta, Ph.D., University of Texas at Austin (Emeritus) //\\ Gordon W. Newell, Ph.D., Palo Alto, CA. //\\ Sidney Shindell, M.D., L.L.B., Medical College of Wisconsin (Emeritus). //\\ Fredrick J. Stare, M.D., Ph.D., Harvard School of Public Health (Emeritus) //\\ Elizabeth M. Whelan, Sc.D., M.P.H., American Council on Science and Health
Volver a la página Pesticidas y Sustancias Químicas Volver a la página Artículos
Usted es el visitante No.:

desde Enero de 2002
FastCounter by bCentral
Vea aquí otras interesantes
estadísticas de la página
¿Desde qué países nos visitan?
¿Quiénes son los visitantes?
